Sebuah persamaan kimia merupakan sebuah cara singkat untuk menjelaskan peristiwa yang terjadi dalam perubahan kimia atau reaksi. Metode untuk merepresentasikan reaksi kimia dengan bantuan simbol-simbol dan rumus dari unsur yang terlibat di dalamnya dikenal sebagai persamaan kimia.
Beberapa hal yang penting mengenai reaksi kimia adalah:
Contoh berikut menggambarkan aspek-aspek dari persamaan kimia:
PENTING
Beberapa hal yang penting mengenai reaksi kimia adalah:
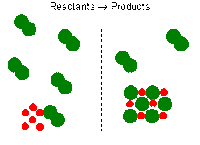
- Zat yang saling bergabung atau bereaksi dikenal sebagai reaktan / pereaksi.
- Zat baru yang dihasilkan dalam reaksi dikenal sebagai produk.
- Reaktan ditulis di sisi kiri dipisahkan oleh tanda +.
- Produk ditulis di sebelah kanan, juga dipisahkan oleh tanda +.
- (g) berarti gas.
- (l) berarti cair.
- (s) berarti padat.
- (aq) menunjukkan suatu larutan berair atau yang dilarutkan dalam air.
- Angka di depan rumus atau simbol disebut koefisien.
- Kondisi yang diperlukan untuk reaksi yang ditentukan di atas atau di bawah panah.
Contoh berikut menggambarkan aspek-aspek dari persamaan kimia:
- Kapur ketika dipanaskan menghasilkan kalsium oksida padat dan gas karbon dioksida.
- Elektrolisis air dalam bentuk cair menghasilkan gas hidrogen dan oksigen.
PENTING
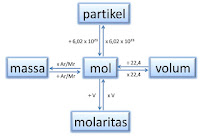
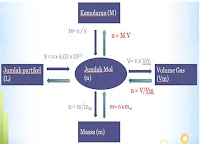
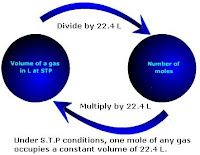
- Koefisien dari suatu reaksi kimia menunjukkan jumlah relatif (meskipun tidak mutlak) reaktan dan produk
- o biasanya menunjukkan jumlah terkecil dari atom, molekul atau ion yang akan memenuhi hukum kekekalan massa
- Massa relatif dari reaktan dan produk dari reaksi kimia dapat ditentukan dari koefisien reaksi ini
- Dapat mengkonversi mol ke massa dalam gram dengan mengalikan dengan massa relatif
- Persamaan kimia memberikan informasi kuantitatif yang berguna tetapi TIDAK memberikan indikasi apakah atau tidak pernah reaksi akan berlangsung