Sifat unsur golongan 1 secara lengkap dibahas di sini. Golongan 1 meliputi unsur litium, natrium, kalium, rubidium, dan cesium. Yang akan dibahas meliputi kecenderungan jari-jari atom, energi ionisasi pertama, elektronegativitas, titik didih dan leleh, dan kepadatan. Inilah pembahasan tentang unsur golongan 1 dalam tabel periodik unsur.
Jari-jari atom
Penjelasan peningkatan jari-jari atom
Jari-jari atom dipengaruhi oleh:
Elektron terluar mendapat tarikan 1 + dari inti. Muatan positif pada inti dihambat oleh kenegatifan dari elektron yang lebih dalam.
Hal ini juga berlaku bagi semua atom lainnya di golongan 1.
Satu-satunya faktor yang akan mempengaruhi ukuran atom adalah karena jumlah lapisan elektron luar yang harus dipasang di sekitar atom.
Energi Ionisasi Pertama
Energi ionisasi pertama adalah energi yang diperlukan untuk melepaskan elektron yang paling lemah ikatannya dari masing-masing satu mol atom gas untuk menghasilkan satu mol ion gas yang bermuatan tunggal :
Perhatikan bahwa energi ionisasi pertama turun.
Penjelasan penurunan energi ionisasi pertama
Energi ionisasi dipengaruhi oleh:
Semakin ke bawah golongan, jarak antara inti dan elektron terluar meningkat sehingga menjadi lebih mudah untuk dihilangkan, dengan kata lain energi ionisasi turun.
Elektronegativitas
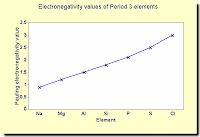
Elektronegativitas adalah ukuran dari kecenderungan sebuah atom untuk menarik pasangan elektron ikatan. Biasanya diukur pada skala Pauling, di mana unsur yang paling elektronegatif (fluor) diberi elektronegativitas dari 4,0.
Semua unsur ini memiliki elektronegatifitas yang sangat rendah. (Ingat bahwa unsur yang paling elektronegatif, fluorine, memiliki elektronegativitas dari 4.0.) Perhatikan bahwa elektronegativitas turun. Atom-atom menjadi kurang dan kurang baik dalam menarik pasangan elektron ikatan.
Penjelasan penurunan elektronegativitas
Bayangkan sebuah ikatan antara atom natrium dan atom klor.Sebagai ikatan kovalen, yaitu penggunaan sepasang elektron bersama. Pasangan elektron akan tertarik ke arah klorin karena ada tarik bersih jauh lebih besar dari inti klorin dibandingkan dari natrium. Tarik bersih dari masing-masing ujung ikatan adalah sama seperti sebelumnya, tetap atom lithium lebih kecil dari atom natrium. Itu berarti bahwa pasangan elektron akan lebih dekat ke muatan 1 + dari ujung lithium, dan jadi lebih kuat tertarik.
Dalam beberapa senyawa lithium sering ada tingkat ikatan kovalen yang tidak ada di seluruh Grup. Iodida Lithium, misalnya, akan larut dalam pelarut organik - properti khas senyawa kovalen. The atom yodium adalah begitu besar sehingga tarikan dari inti yodium pada pasangan elektron relatif lemah, sehingga ikatan ionik tidak sepenuhnya terbentuk.
Titik lebur dan titik didih
Anda akan melihat bahwa baik titik lebur dan titik didih semakin turun.
Penjelasan kecenderungan leleh dan titik didih
Bila Anda mencairkan salah satu logam, ikatan logam yang melemah cukup untuk atom untuk bergerak di sekitar, dan kemudian ikatannya menjadi putus apabila logam dididihkan.
Atom dalam logam mempunyai daya tarik inti terhadap elektron yang terdelokalisasi. Jika atom menjadi lebih besar, inti semakin menjauh dari elektron ini terdelokalisasi, dan sebagainya atraksi jatuh. Itu berarti bahwa atom lebih mudah terpisah untuk membentuk cairan dan akhirnya gas.
Dengan cara yang sama bahwa kita telah dibahas, masing-masing atom ini memiliki tarikan dari inti 1 +. Muatan meningkat pada inti dari atas ke bawah Grup tersebut diimbangi dengan tingkat tambahan elektron skrining. Yang penting adalah jarak antara inti dan elektron ikatan.
Kepadatan
Perhatikan semua logam ringan dan tiga pertama di golongan kurang padat daripada air (kurang dari 1 g cm-3). Itu berarti bahwa tiga pertama akan mengapung di atas air, sementara dua lainnya tenggelam.
Kepadatan cenderung meningkat saat Anda turun Group (terlepas dari fluktuasi pada kalium).
Penjelasan kecenderungan kepadatan
Hal ini cukup sulit untuk datang dengan penjelasan sederhana untuk ini, karena berat jenis tergantung pada dua faktor, yang keduanya berubah saat Anda pergi ke Grup.
Semua logam ini memiliki atom mereka dikemas dengan cara yang sama, sehingga semua yang harus Anda pertimbangkan adalah berapa banyak atom yang bisa termuat dalam volume tertentu, dan berapa massa atom individu. Berapa banyak Anda dapat pak tergantung, tentu saja, pada volumenya - dan volume mereka, pada gilirannya, tergantung pada jari-jari atom mereka.
Ketika Anda pergi ke Grup, meningkat jari-jari atom, sehingga volume atom meningkat juga. Itu berarti bahwa Anda tidak dapat pak sebagai atom natrium banyak ke dalam volume tertentu yang Anda bisa atom lithium.
Namun, karena Anda turun Group, massa atom meningkat. Itu berarti bahwa sejumlah tertentu atom natrium akan berbobot lebih dari jumlah yang sama dari atom lithium.
Jadi 1 cm3 natrium akan mengandung atom lebih sedikit dibandingkan dengan volume yang sama dari lithium, tetapi setiap atom akan lebih berat.
Jari-jari atom
Penjelasan peningkatan jari-jari atom
Jari-jari atom dipengaruhi oleh:
- jumlah lapisan elektron di sekitar inti
- tarik elektron terluar dari inti.
Elektron terluar mendapat tarikan 1 + dari inti. Muatan positif pada inti dihambat oleh kenegatifan dari elektron yang lebih dalam.
Hal ini juga berlaku bagi semua atom lainnya di golongan 1.
Satu-satunya faktor yang akan mempengaruhi ukuran atom adalah karena jumlah lapisan elektron luar yang harus dipasang di sekitar atom.
Energi Ionisasi Pertama
Energi ionisasi pertama adalah energi yang diperlukan untuk melepaskan elektron yang paling lemah ikatannya dari masing-masing satu mol atom gas untuk menghasilkan satu mol ion gas yang bermuatan tunggal :
Perhatikan bahwa energi ionisasi pertama turun.
Penjelasan penurunan energi ionisasi pertama
Energi ionisasi dipengaruhi oleh:
- muatan pada inti,
- jumlah skrining oleh elektron dalam,
- jarak antara elektron terluar dan inti.
Semakin ke bawah golongan, jarak antara inti dan elektron terluar meningkat sehingga menjadi lebih mudah untuk dihilangkan, dengan kata lain energi ionisasi turun.
Elektronegativitas
Elektronegativitas adalah ukuran dari kecenderungan sebuah atom untuk menarik pasangan elektron ikatan. Biasanya diukur pada skala Pauling, di mana unsur yang paling elektronegatif (fluor) diberi elektronegativitas dari 4,0.
Semua unsur ini memiliki elektronegatifitas yang sangat rendah. (Ingat bahwa unsur yang paling elektronegatif, fluorine, memiliki elektronegativitas dari 4.0.) Perhatikan bahwa elektronegativitas turun. Atom-atom menjadi kurang dan kurang baik dalam menarik pasangan elektron ikatan.
Penjelasan penurunan elektronegativitas
Bayangkan sebuah ikatan antara atom natrium dan atom klor.Sebagai ikatan kovalen, yaitu penggunaan sepasang elektron bersama. Pasangan elektron akan tertarik ke arah klorin karena ada tarik bersih jauh lebih besar dari inti klorin dibandingkan dari natrium. Tarik bersih dari masing-masing ujung ikatan adalah sama seperti sebelumnya, tetap atom lithium lebih kecil dari atom natrium. Itu berarti bahwa pasangan elektron akan lebih dekat ke muatan 1 + dari ujung lithium, dan jadi lebih kuat tertarik.
Dalam beberapa senyawa lithium sering ada tingkat ikatan kovalen yang tidak ada di seluruh Grup. Iodida Lithium, misalnya, akan larut dalam pelarut organik - properti khas senyawa kovalen. The atom yodium adalah begitu besar sehingga tarikan dari inti yodium pada pasangan elektron relatif lemah, sehingga ikatan ionik tidak sepenuhnya terbentuk.
Titik lebur dan titik didih
Anda akan melihat bahwa baik titik lebur dan titik didih semakin turun.
Penjelasan kecenderungan leleh dan titik didih
Bila Anda mencairkan salah satu logam, ikatan logam yang melemah cukup untuk atom untuk bergerak di sekitar, dan kemudian ikatannya menjadi putus apabila logam dididihkan.
Atom dalam logam mempunyai daya tarik inti terhadap elektron yang terdelokalisasi. Jika atom menjadi lebih besar, inti semakin menjauh dari elektron ini terdelokalisasi, dan sebagainya atraksi jatuh. Itu berarti bahwa atom lebih mudah terpisah untuk membentuk cairan dan akhirnya gas.
Dengan cara yang sama bahwa kita telah dibahas, masing-masing atom ini memiliki tarikan dari inti 1 +. Muatan meningkat pada inti dari atas ke bawah Grup tersebut diimbangi dengan tingkat tambahan elektron skrining. Yang penting adalah jarak antara inti dan elektron ikatan.
Kepadatan
Perhatikan semua logam ringan dan tiga pertama di golongan kurang padat daripada air (kurang dari 1 g cm-3). Itu berarti bahwa tiga pertama akan mengapung di atas air, sementara dua lainnya tenggelam.
Kepadatan cenderung meningkat saat Anda turun Group (terlepas dari fluktuasi pada kalium).
Penjelasan kecenderungan kepadatan
Hal ini cukup sulit untuk datang dengan penjelasan sederhana untuk ini, karena berat jenis tergantung pada dua faktor, yang keduanya berubah saat Anda pergi ke Grup.
Semua logam ini memiliki atom mereka dikemas dengan cara yang sama, sehingga semua yang harus Anda pertimbangkan adalah berapa banyak atom yang bisa termuat dalam volume tertentu, dan berapa massa atom individu. Berapa banyak Anda dapat pak tergantung, tentu saja, pada volumenya - dan volume mereka, pada gilirannya, tergantung pada jari-jari atom mereka.
Ketika Anda pergi ke Grup, meningkat jari-jari atom, sehingga volume atom meningkat juga. Itu berarti bahwa Anda tidak dapat pak sebagai atom natrium banyak ke dalam volume tertentu yang Anda bisa atom lithium.
Namun, karena Anda turun Group, massa atom meningkat. Itu berarti bahwa sejumlah tertentu atom natrium akan berbobot lebih dari jumlah yang sama dari atom lithium.
Jadi 1 cm3 natrium akan mengandung atom lebih sedikit dibandingkan dengan volume yang sama dari lithium, tetapi setiap atom akan lebih berat.