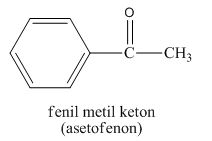
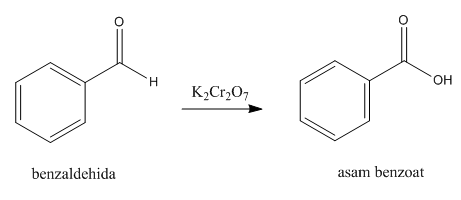
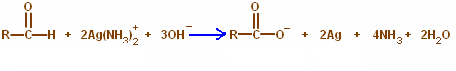
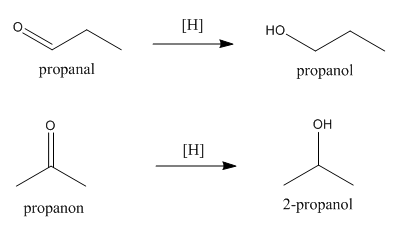
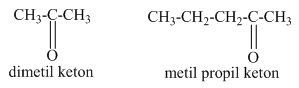Pengertian Reaksi Esterifikasi
Esterifikasi adalah reaksi pengubahan dari suatu asam karboksilat dan alkohol menjadi suatu ester dengan menggunakan katalis asam. Reaksi ini juga sering disebut esterifikasi Fischer. Ester adalah suatu senyawa yang mengandung gugus -COOR dengan R dapat berbentuk alkil maupun aril. Suatu ester dapat dibentuk dengan reaksi esterifikasi berkatalis asam. Reaksi esterifikasi merupakan reaksi dapat balik (reversible).
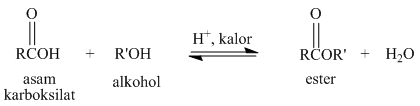
Laju esterifikasi suatu asam karboksilat bergantung terutama pada halangan sterik dalam alkohol dan asam karboksilatnya. Kuat asam dari asam karboksilat hanya memainkan peranan kecil dalam pembentukan ester. Untuk alasan sterik, urutan reaktivitas alkohol untuk reaksi esterifikasi adalah metanol > alkohol 1º > alkohol 2º > alkohol 3º.
Perhatikan bahwa dalam reaksi esterifikasi, ikatan yang terputus adalah ikatan C-O asam karboksilat dan bukan -OH dari asam atau ikatan C-O dari alkohol.
Reaksi esterifikasi bersifat reversibel. Untuk memperoleh rendemen tinggi dari ester, kesetimbangan harus digeser ke arah sisi ester. Satu teknik untuk mencapainya adalah menggunakan salah satu zat pereaksi yang murah secara berlebihan. Teknik lain yaitu membuang salah satu produk dalam campuran reaksi (misalnya dengan destilasi air secara azeotropik).
Dengan bertambahnya halangan sterik dalam zat antara, laju pembentukan ester akan menurun. Rendemen esternya pun berkurang. Alasannya ialah karena esterifikasi itu merupkan suatu reaksi yang bersifat dapat balik dan spesies yang kurang terintangi (pereaksi) akan lebih disukai. Jika suatu ester yang meruah (bulky) harus dibuat, maka lebih baik digunakan jalur sintesis lain, seperti reaksi antara alkohol dengan suatu anhidrida asam atau klorida asam, yang lebih reaktif daripada asam karboksilat dan dapat bereaksi secara tak dapat balik.
Ester fenil umumnya tidak dibuat dengan secara langsung dari fenol dan asam karboksilat karena kesetimbangan cenderung bergeser ke sisi pereaksi daripada produk. Ester fenil dapat diperoleh dengan menggunakan derivat asam yang lebih reaktif.

Laju esterifikasi suatu asam karboksilat bergantung terutama pada halangan sterik dalam alkohol dan asam karboksilatnya. Kuat asam dari asam karboksilat hanya memainkan peranan kecil dalam pembentukan ester. Untuk alasan sterik, urutan reaktivitas alkohol untuk reaksi esterifikasi adalah metanol > alkohol 1º > alkohol 2º > alkohol 3º.
Contoh Reaksi Esterifikasi
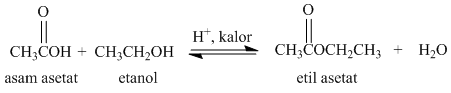
Contoh reaksi esterifikasi adalah reaksi antara asam asetat dan etanol membentuk etil asetat. Reaksinya adalah:
Mekanisme Reaksi Esterifikasi
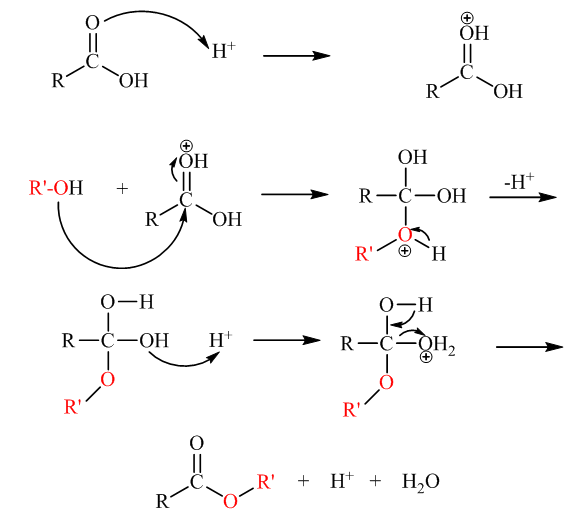
Seperti banyak reaksi aldehida dan keton, esterifikasi asam karboksilat berlangsung melalui serangkaian tahap protonasi dan deprotonasi. Oksigen karbonil diprotonasi, alkohol nukleofilik menyerang karbon positif, dan eliminasi air akan menghasilkan ester yang dimaksud. Inilah mekanisme reaksi esterifikasi:
Perhatikan bahwa dalam reaksi esterifikasi, ikatan yang terputus adalah ikatan C-O asam karboksilat dan bukan -OH dari asam atau ikatan C-O dari alkohol.
Reaksi esterifikasi bersifat reversibel. Untuk memperoleh rendemen tinggi dari ester, kesetimbangan harus digeser ke arah sisi ester. Satu teknik untuk mencapainya adalah menggunakan salah satu zat pereaksi yang murah secara berlebihan. Teknik lain yaitu membuang salah satu produk dalam campuran reaksi (misalnya dengan destilasi air secara azeotropik).
Dengan bertambahnya halangan sterik dalam zat antara, laju pembentukan ester akan menurun. Rendemen esternya pun berkurang. Alasannya ialah karena esterifikasi itu merupkan suatu reaksi yang bersifat dapat balik dan spesies yang kurang terintangi (pereaksi) akan lebih disukai. Jika suatu ester yang meruah (bulky) harus dibuat, maka lebih baik digunakan jalur sintesis lain, seperti reaksi antara alkohol dengan suatu anhidrida asam atau klorida asam, yang lebih reaktif daripada asam karboksilat dan dapat bereaksi secara tak dapat balik.
Ester fenil umumnya tidak dibuat dengan secara langsung dari fenol dan asam karboksilat karena kesetimbangan cenderung bergeser ke sisi pereaksi daripada produk. Ester fenil dapat diperoleh dengan menggunakan derivat asam yang lebih reaktif.