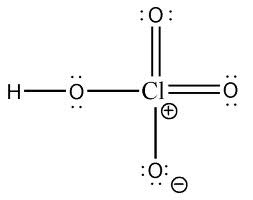
Dalam air, semua asam-asam kuat tersebut nampaknya mempunyai kekuatan yang relatif sama, terionisasi hampir 100%. Dalam hal ini air dikatakan bertindak sebagai pelarut penyama, leveling solvent, karena menghasilkan ion hidronium, H3O+, yang merupakan kemungkinan asam terkuat dalam larutan air. Untuk mengidentifikasi asam mana yang lebih kuat secara kualitatif dapat dilakukan dengan melarutkan asam-asam yang bersangkutan ke dalam suatu basa yang lebih lemah daripada air. Basa yang lebih lemah ini, yang sering berupa asam lemah murni akan bertindak sebagai pelarut pembeda (differentiating solvent) bagi asam-asam. Sebagai contoh adalah asam perklorat dalam pelarut hidrogen fluorida yang mengalami ionisasi menurut persamaan reaksi keseimbangan berikut:
HClO4 (HF) + HF (l)  H2F+ (HF) + ClO4- (HF)
H2F+ (HF) + ClO4- (HF)
Asam yang lebih lemah, HF, dalam campuran ini bertinda sebagai basa yaitu akseptor (penerima) proton bagi asam perklorat yang lebih kuat sebagai donor proton. Tetapi, karena asam fluorida bersifat basa lebih lemah daripada air, reaksi keseimbangan tersebut tidak sepenuhnya menggeser ke kanan, yaitu ke arah produk, seperti halnya yang terjadi dalam pelarut air. Percobaan seperti ini dapat dilakukan bagi asam-asam yang lain, sehingga diperoleh harga tetapan keseimbangan yang berbeda-beda, dan ternyata asam perklorat merupakan asam yang paling kuat.
Rating:
100%
based on 10 ratings.
5 user reviews.




0 komentar:
Posting Komentar