Suatu orbital hibrida sp adalah setengah s dan setengah p, sehingga dapat dikatakan bahwa orbital spmempunyai 50% karakter s dan 50% karakter p. Pada contoh yang lain adalah sp3 yang hanya mempunyai seperempat atau 25% karakter s.
Karena orbital sp mengandung lebih banyak karakter s, maka lebih banyak dekat ke intinya, membentuk ikatan yang lebih pendek dan lebih kuat daripada orbital sp3. Orbital sp2 adalah perantara antara sp dan sp3 dalam karakter s-nya dan dalam panjang dan kekuatan ikatan yang dibentuknya.
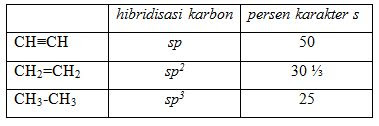
Tabel di atas menunjukkan bahwa perbedaan panjang ikatan antara tiga jenis ikatan C-C dan C-H. Perhatikan bahwa ikatan sp-s CH dalam CH≡CH adalah yang tependek, sedangkan ikatan sp3-s CH adalah yang terpanjang. Variasi lebih luas dalam ikatan C-C karena panjang ikatan ini dipengaruhi oleh banyaknya ikatan yang menggabungkan atom karbon maupun oleh hibidisasi dari atom karbon.
Rating:
100%
based on 10 ratings.
5 user reviews.




0 komentar:
Posting Komentar