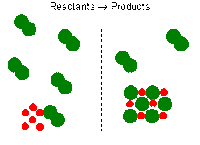
Konsep perhitungan pereaksi pembatas. Dalam beberapa reaksi kimia, sering ada yang disebut sebagai pereaksi pembatas (limiting reagent) dan peraksi berlebih (excess reagent). Terutama jika terdapat perbedaan jumlah zat yang direaksikan. Maka dari itu, disini akan dibahas bagaimana perhitungan yang melibatkan pereaksi pembatas.
Konsep Kunci
Memilih pereaksi yang digunakan sebagai pembatas dan yang berlebih.
CONTOH
Konsep Kunci
- Pereaksi (reaktan) pembatas adalah pereaksi yang benar-benar habis digunakan selama reaksi kimia.
- Pereaksi yang berlebih adalah reaktan yang tidak sepenuhnya habis digunakan selama reaksi kimia, dengan kata lain ada beberapa dari reaktan yang tersisa setelah reaksi.
Memilih pereaksi yang digunakan sebagai pembatas dan yang berlebih.
- Tuliskan persamaan reaksi setara untuk reaksi kimia
- Hitung mol yang tersedia dari tiap reaktan dalam reaksi kimia
- Gunakan persamaan reaksi setara untuk menentukan rasio mol dari reaktan dalam reaksi kimia
- Bandingkan mol yang tersedia dari tiap reaktan ke mol yang diperlukan untuk reaksi lengkap dengan menggunakan rasio mol
- Reagen pembatas adalah reaktan yang akan benar-benar habis digunakan. Akan ada beberapa mol reaktan yang tersisa setelah reaksi selesa, yang disebut pereaksi berlebih.
CONTOH
Jika diketahui mol reaktan
Cari pereaksi pembatas dan pereaksi berlebih ketika 0,5 mol Zn bereaksi dengan 0,4 mol HCl- Tuliskan persamaan reaksi setara untuk reaksi kimia Zn + 2HCl -----> ZnCl2 + H2
- Hitung mol yang tersedia dari tiap reaktan dalam reaksi kimia
mol Zn = 0,5 mol HCl = 0,4 - Gunakan persamaan reaksi setara untuk menentukan rasio mol reaktan dalam reaksi kimia
Zn: HCl Atau HCl: Zn 1: 2 1: ½ - Bandingkan mol yang tersedia dari tiap pereaksi ke mol yang diperlukan untuk reaksi lengkap dengan menggunakan rasio mol. Jika digunakan 0,5 mol Zn, reaksi itu akan membutuhkan
2 x 0,5 = 1,0 mol HCl untuk reaksi.
Hanya ada 0,4 mol HCl yang tersedia yang kurang dari 1,0 mol dibutuhkan. Jika digunakan 0,4 mol HCl, reaksi itu akan membutuhkan
½ x 0,4 = 0,2 mol Zn.
Ada 0,5 mol Zn yang tersedia, sedangkan yang dibutuhkan 0,2 mol. - Reagen pembatas adalah reaktan yang akan benar-benar habis digunakan selama reaksi kimia.
Akan ada beberapa mol reaktan yang melebihi tersisa setelah reaksi selesai. Pereaksi pembatas adalah HCl. 0,4 mol HCl akan digunakan ketika reaksi ini berlangsung sampai selesai. Pereaksi berlebih adalah Zn,
ketika reaksi selesai akan masih ada 0,5-0,2 = 0,3 mol Zn .
Jika diketahui massa reaktan
Cari pereaksi pembatas dan pereaksi berlebih ketika 1.5 g CaCO 3 bereaksi dengan 0.73 g HCl
- Tuliskan persamaan reaksi setara untuk reaksi kimia CaCO3 + 2HCl -----> CaCl2 + CO2 + H 2O
- Hitung mol yang tersedia dari tiap pereaksi
mol CaCO 3 = massa ÷ MM
massa = 1.5g
MM = 40.08 + 12.01 + (3 x 16.00)
= 100,09 g / mol
mol CaCO3 = 1,5 ÷ 100,09
= 0,015 molmol HCl = massa ÷ MM
massa = 0.73g
MM = 1,008 + 35,45
= 36.458g/mol
mol HCl = 0,73 ÷ 36,458
= 0,02 mol - Gunakan persamaan reaksi setara untuk menentukan rasio mol reaktan dalam reaksi kimia
CaCO 3: HCl Atau HCl: CaCO 3 1: 2 1: ½ - Bandingkan mol yang tersedia dari tiap reaktan ke mol yang diperlukan untuk reaksi lengkap dengan menggunakan rasio molJika semua 0,015 mol CaCO 3 yang akan digunakan dalam reaksi itu akan membutuhkan
2 x 0,015 = 0,03 mol HCl untuk reaksi sampai selesai.
Ada hanya 0,02 mol HCl yang tersedia yang kurang dari 0,03 mol dibutuhkan. Jika semua 0,02 mol HCl yang akan digunakan dalam reaksi itu akan membutuhkan
½ x 0,02 = 0,01 mol CaCO 3.
Ada 0,015 mol CaCO 3 yang tersedia yang lebih dari 0,01 mol dibutuhkan. - Reagen pembatas adalah reaktan yang akan benar-benar digunakan selama reaksi kimia.
Akan ada beberapa mol reaktan yang melebihi tersisa setelah reaksi telah sampai selesai.Reagen pembatas adalah HCl,
semua 0,02 mol HCl akan digunakan ketika reaksi ini berlangsung sampai selesai. Reaktan lebih adalah CaCO 3,
ketika reaksi telah sampai selesai akan ada
0,015-0,01 = 0,005 mol CaCO 3 tersisa.
Jika diketahui volume dan konsentrasi larutan
Tuliskan persamaan reaksi setara untuk reaksi kimiaCari reagen pembatas dan reaktan lebih ketika 100 ml NaOH 0,2 bereaksi sepenuhnya dengan 50ml dari 0.5MH 2 SO 4- 2NaOH + H 2SO4 -----> Na 2SO4 + 2H2O
- Hitung mol yang tersedia dari tiap reaktan dalam reaksi kimia
mol NaOH = M x V
M 0,2 M =
V = 100ml
= 100 x 10 L -3mol NaOH = 0.2 x 100 x 10 -3
= 0,02 molmol H2SO4 = M x V
M 0,5 M =
V = 50ml
= 50 x 10 L -3mol H 2 SO 4 = 0,5 x 50 x 10 -3
= 0.025mol - Gunakan persamaan reaksi setara untuk menentukan rasio mol reaktan dalam reaksi kimia
NaOH: H2SO4 Atau H2SO4: NaOH 1: ½ 1: 2 - Bandingkan mol yang tersedia dari tiap reaktan ke mol yang diperlukan untuk reaksi lengkap dengan menggunakan rasio molJika semua 0,02 mol NaOH yang akan digunakan dalam reaksi itu akan membutuhkan
½ x 0,02 = 0,01 mol H 2 SO 4 untuk reaksi sampai selesai.
Ada 0,025 mol H 2 SO 4 tersedia yang merupakan lebih dari 0,01 mol dibutuhkan. Jika semua 0,025 mol H 2 SO 4 yang akan digunakan dalam reaksi itu akan membutuhkan
2 x 0,025 = 0,05 mol NaOH.
Ada hanya 0,02 mol NaOH tersedia yang kurang dari 0,05 mol dibutuhkan. - Reagen pembatas adalah reaktan yang akan benar-benar digunakan selama reaksi kimia.
Akan ada beberapa mol reaktan yang melebihi tersisa setelah reaksi telah sampai selesai.Reagen pembatas adalah NaOH,
semua 0,02 mol NaOH akan digunakan ketika reaksi ini berlangsung sampai selesai. Reaktan lebih adalah H 2 SO 4,
ketika reaksi telah sampai selesai akan ada
0,025-0,01 = 0,015 mol H 2 SO 4 tersisa.
Jika diketahui volume gas
Cari reagen pembatas dan reaktan lebih ketika 44.82L CO (g) bereaksi sepenuhnya dengan 11.205L O 2 (g) pada STP (0 o C atau 273K dan 1ATM atau 101.3kPa)
- Tuliskan persamaan reaksi setara untuk reaksi kimia2CO (g) + O 2 (g) -----> 2CO 2 (g)
- Hitung mol yang tersedia dari tiap reaktan dalam reaksi kimia
mol CO = V ÷ 22.41
Pada STP 1 mol gas
memiliki volume 22.41Lmol CO = 44,82 ÷ 22.41
= 2molmol O 2 = V ÷ 22.41
Pada STP 1 mol gas
memiliki volume 22.41Lmol O 2 = 11,205 ÷ 22.41
= 0.5mol - Gunakan persamaan reaksi setara untuk menentukan rasio mol reaktan dalam reaksi kimia
CO: O 2 Atau O 2: CO 1: ½ 1: 2 - Bandingkan mol yang tersedia dari tiap reaktan ke mol yang diperlukan untuk reaksi lengkap dengan menggunakan rasio molJika semua 2 mol CO yang akan digunakan dalam reaksi itu akan membutuhkan
½ x 2 = 1 mol O 2 untuk reaksi sampai selesai.
Ada 0,5 mol O 2 yang tersedia yang kurang dari 1 mol dibutuhkan. Jika semua 0,5 mol O 2 yang akan digunakan dalam reaksi itu akan membutuhkan
2 x 0,5 = 1 mol CO
Ada 2 mol CO yang tersedia yang lebih dari 1 mol dibutuhkan. - Reagen pembatas adalah reaktan yang akan benar-benar digunakan selama reaksi kimia. Akan ada beberapa mol reaktan yang melebihi tersisa setelah reaksi telah sampai selesai.Reagen pembatas adalah O 2,
semua 0,5 mol O 2 akan digunakan ketika reaksi ini berlangsung sampai selesai. Reaktan dalam kelebihan CO,
ketika reaksi telah sampai selesai akan ada
2 - 1 = 1 mol CO tersisa.
Rating:
100%
based on 10 ratings.
5 user reviews.




0 komentar:
Posting Komentar