Pengertian Elektrolit
Elektrolit adalah senyawa yang dapat terdisosiasi ketika dilarutkan dalam air membentuk ion (anion dan kation) dan bersifat menghantarkan listrik. Senyawa-senyawa seperti asam, basa, dan garam dapat menghantarkan arus listrik karena proses disosiasi, maka disebut dengan larutan elektrolit. Adanya ion dalam larutan menyebabkan peristiwa konduksi dan ketika arus listrik dilewatkan pada larutan tersebut, maka elektron akan bergerak di antara ion-ion.
Reaksi disosiasi elektrolit kuat ditulis dengan tanda anak panah tunggal ke kanan. Secara umum asam kuat seperti asam sulfat, asam nitrat, asam klorida, dan basa kuat seperti kalium hidroksida dan garam adalah elektrolit kuat. Sebagai contoh:
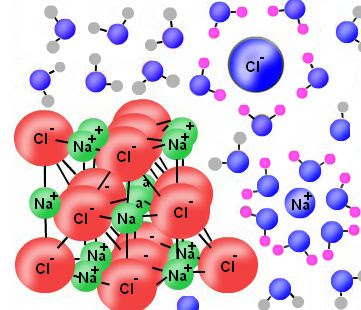
Sebagai contoh, ketika natrium klorida dilarutkan dalam air, gaya interaksi elektrostatis antara ion-ion memfasilitasi pergerakan ion. Ion bebas ini terstabilkan oleh proses solvasi air. Dalam proses pelarutan, ion natrium dan ion klorida dikelilingi oleh molekul air karena interaksi dipol-ion. Pelarutan dengan molekul air disebut dengan proses reaksi hidrasi.
Karena hanya sebagian yang terdisosiasi, maka jumlah ion pada volume tertentu larutan akan sama pada perubahan konsentrasi yang besar. Persamaan kimia ionisasi elektrolit lemah digunakan tanda panah ganda (⇌). Sebagai contoh, reaksi disosiasi asam asetat ditulis:
Senyawa kovalen mempunyai ikatan kovalen antara atom yang berikatan, dengan demikian tidak dapat terionisasi pada larutan dan hanya membentuk molekul. Sebagai contoh, gula dan alkohol dapat larut dalam air, tetapi hanya sebagai molekulnya saja.
Elektrolit Kuat
Beberapa elektrolit seperti kalium klorida, natrium hidroksida, natrium nitrat terionisasi sempurna menjadi ion-ionnya dalam larutan. Elektrolit yang terioniasi sempurna disebut dengan elektrolit kuat. Dengan kata lain, elektrolit kuat terionisasi 100%.Reaksi disosiasi elektrolit kuat ditulis dengan tanda anak panah tunggal ke kanan. Secara umum asam kuat seperti asam sulfat, asam nitrat, asam klorida, dan basa kuat seperti kalium hidroksida dan garam adalah elektrolit kuat. Sebagai contoh:
KCl (aq) → K+ (aq) + Cl- (aq)
NH4NO3 (aq) → NH4+ (aq) + NO3- (aq)
HNO3 (aq) → H+ (aq) + NO3- (aq)
NaOH (aq) → Na+ (aq) + OH- (aq)
NH4NO3 (aq) → NH4+ (aq) + NO3- (aq)
HNO3 (aq) → H+ (aq) + NO3- (aq)
NaOH (aq) → Na+ (aq) + OH- (aq)
Sebagai contoh, ketika natrium klorida dilarutkan dalam air, gaya interaksi elektrostatis antara ion-ion memfasilitasi pergerakan ion. Ion bebas ini terstabilkan oleh proses solvasi air. Dalam proses pelarutan, ion natrium dan ion klorida dikelilingi oleh molekul air karena interaksi dipol-ion. Pelarutan dengan molekul air disebut dengan proses reaksi hidrasi.
 |
Elektrolit Lemah
Elektrolit lemah adalah senyawa yang terdisosiasi sebagian dalam air. Pada larutan elektrolit lemah, ion-ion akan membentuk kesetimbangan dengan molekul yang tak terdisosiasi.Karena hanya sebagian yang terdisosiasi, maka jumlah ion pada volume tertentu larutan akan sama pada perubahan konsentrasi yang besar. Persamaan kimia ionisasi elektrolit lemah digunakan tanda panah ganda (⇌). Sebagai contoh, reaksi disosiasi asam asetat ditulis:
CH3COOH (aq) + H2O (aq) ⇌ H3O+ (l) + CH3COO- (aq)
Non-elektrolit
Non-elektrolit adalah larutan yang tidak dapat menghantarkan listrik karena tidak adanya ion. Biasanya senyawa non elektrolit adalah senyawa kovalen polar dan non polar yang mana terlarut dalam air sebagai molekul, bukan ion.Senyawa kovalen mempunyai ikatan kovalen antara atom yang berikatan, dengan demikian tidak dapat terionisasi pada larutan dan hanya membentuk molekul. Sebagai contoh, gula dan alkohol dapat larut dalam air, tetapi hanya sebagai molekulnya saja.
C12H22O11 (s) → C12H22O11 (aq)
Rating:
100%
based on 10 ratings.
5 user reviews.




0 komentar:
Posting Komentar